[RANGKUMAN DAN MATERI LENGKAP] Zat dan Karakteristiknya
DAFTAR ISI
--------------------------------------------------------------------------------------------------------------------------
MATERI VERSI RINGKAS
Berikut ini merupakan materi versi ringkas kelas 7 : Zat dan Karakteristiknya. Selamat belajar :)(Zat dan Karakteristiknya)
A. Wujud Zat (zat padat, zat cair, dan zat gas)
1. Perbedaan zat padat, zat cair, dan zat gas
2. Perubahan wujud zat
B. Zat Tunggal
1. Unsur
a. Pengertian unsur
unsur adalah zat tunggal yang paling sederhana dan tidak dapat diuraikan menjadi zat lain.b. Penulisan lambang unsur
1) Zaman alkimia
2) Lambang unsur dalton
3) Lambang unsur berzelius
- Menggunakan nama unsur dalam bahasa Latin.
- Lambang unsur diambil dari huruf pertama nama unsur tersebut dan ditulis dengan huruf kapital.
- Jika ada unsur-unsur yang memiliki huruf pertama dari namanya sama, maka lambang dari salah satu unsur ditambah lagi satu huruf yang ditulis dengan huruf kecil.
- Contoh Karbon (nama latinnya Carbon) dilambangkan dengan (C), Kalsium (nama latinnya Calsium) dilambangkan dengan (Ca).
selanjutnya unsur-unsur disusun kedalam sebuah tabel periodik:
c. Jenis-jenis unsur
1) Unsur logam
- Berwujud padat pada suhu kamar
- Konduktor listrik dan panas yang baik
- Mengilap jika digosok
- Dapat ditempa dan dibentuk
- memiliki titik didih dan titik leleh yang tinggi
- massa jenisnya umumnya tinggi.
- Contoh: Khrom (Cr), Besi (Fe), Nikel ( Ni ), Tembaga (Cu), Seng (Zn), Platina (Pt), Emas (Au)
2) Unsur non logam
- ada yang berwujud padat, cair, atau gas;
- Konduktor listrik dan panas yang buruk
- Tidak mengilap jika digosok
- Tidak dapat ditempa dan dibentuk
- memiliki titik didih dan titik leleh yang rendah
- massa jenisnya umumnya rendah.
- Contoh:Fluor (F), Brom (Br), Yodium (I)
3) Unsur semi logam
- Merupakan unsur yang menunjukan sifat logam sekaligus non logam
- Contoh: silikon (Si) dan Germanium (Ge)
2. Senyawa
a. Pengertian senyawa
- senyawa adalah zat yang tersusun oleh dua unsur atau lebih yang berbeda dan dapat diuraikan menjadi zat yang lebih sederhana melalui suatu reaksi kimia. Bagian terkecil dari senyawa disebut molekul. Molekul dibedakan menjadi dua yaitu:
- Molekul unsur (molekul yang tersusun dari unsur yang sama) Contohnya, H₂ (hydrogen), O₂ (oksigen)
- Molekul senyawa (molekul yang tersusun dari unsur yang berbeda) contohnya karbon dioksina (CO₂) dan karbon monoksida (CO)
- Sifat senyawa berbeda dengan sifat unsur-unsur penyusunnya.
b. Aturan penamaan senyawa
- • Senyawa bineer logam dan non logam
nama logam + nama non logam + ida
Contoh :
KBr = kalium + bromium + ida = kalium bromidaMgO = magnesium + oksigen + ida = magnesium oksida
• Senyawa biner sesama unsur logam
jumlah atom I + nama nonlogam I + jumlah atom II + nama nonlogam II + ida
Contoh :
CO₂ = karbon + di + oksigen + ida = karbon dioksidaN₂O = di + nitrogen + mono + oksigen + ida =dinitrogen monoksida
• Senyawa asam
harus dinamai dengan awalan asam dan jika mengandung unsur oksigen diberi akhiran at atau it.Contoh:
HF = asam flouridaHCl = asam kloridaHNO₃ = asam nitratHNO₂ = asan nitrit
• Senyawa basa
Basa dinamai dengan menyebut nama logamnya lalu diikuti kata hidroksidaContoh :
NaOH = natrium hidroksidaKOH = kalium hidroksidaMg(OH)₂ = magnesium hidroksidaAl (OH)₃ = alumunium hidroksida
C. Campuran
Campuran adalah gabungan dari dua zat atau lebih yang sifat asalnya tidak hilang sama sekali.
1. Campuran homogen (larutan)
campuran homogen adalah campuran yang zat terlarut dan pelarut nya tidak dapat dibedakan. Ciri-ciri campuran homogen diantaranya:
- Ukuran partikel zat yang bercampur berukuran molekul
- Partikel zat bercampur merata
- Tidak mengendap
- Bening dan tembus cahaya
- Contoh larutan : campuran air dengan gula
Berdasarkan sifat kimianya larutan dikelompokkan menjadi tiga, yaitu larutan asam, larutan basa, dan larutan garam.
a) Asam
- mempunyai rasa masam (tetapi jangan mencicipinya);
- mengubah lakmus biru menjadi merah;
- tidak mengubah warna lakmus merah;
- dapat menghantarkan arus listrik (asam kuat);
- jika dilarutkan dalam air akan melepaskan ion hidrogen (H⁺);
- bersifat korosif terhadap logam.;
- dapat menetralkan basa.
- memiliki Nilai PH < 7
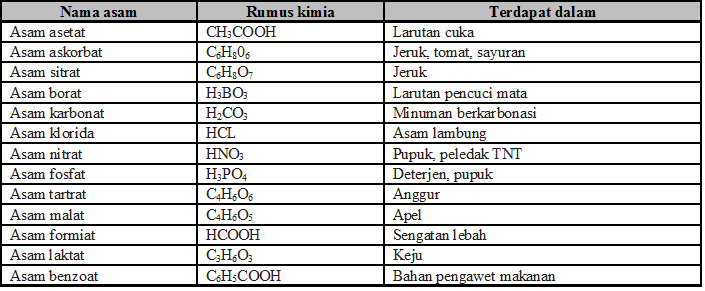
- Beberapa asam yang sering dijumpai:
b) Basa
- terasa licin jika terkena kulit (tidak untuk dicoba di kulit, berbahaya),
- rasanya pahit (tetapi jangan mencicipinya)
- tidak mengubah warna lakmus biru
- mengubah lakmus merah menjadi biru,
- dapat menghantarkan arus listrik (basa kuat),
- jika dilarutkan dalam air akan melepaskan ion hidroksil (OH⁻), dan
- dapat menetralkan asam
- memiliki nilai PH > 7
- beberapa basa yang sering dijumpai:
c) Garam
- Rasanya manis, asin, atau tidak berasa (hambar)
- dapat menghantarkan arus listrik,
- tidak mengubah warna lakmus merah maupun biru.
- Tidak menghasilkan ion H⁺ atau ion OH⁻
- Memilki nilai PH = 7
- beberapa garam yang sering dijumpai:
d) Indikator asam, basa, dan garam.
1) Indikator alami
2) Indikator buatan
2. Campuran heterogen,
campuran heterogen adalah campuran yang zat terlarut dan pelarutnya masih bisa dibedakan.
a) Suspensi
- Ukuran partikel yang bercampur lebih besar dari molekul
- Percampuran partikel tidak merata
- Campuran akan mengendap jika didiamkan
- Keruh dan tidak tembus cahaya
- Dapat dipisahkan melalui penyaringan
- Contohnya : campuran air dengan pasir
b) Koloid
- Ukuran partikel yang bercampur lebih besar dari partikel larutan, tetapi lebih kecil dari partikel suspense
- Percampuran partikel tampak merata
- Tidak akan mengendap jika didiamkan
- Keruh, tetapi dapat menghamburkan cahaya
- Dapat dipisahkan dengan penyaringan ultra
D. Metode pemisahan campuran
1. Filtrasi (penyaringan)
Pemisahan campuran dengan penyaringan di dasarkan pada perbedaan ukuran partikel-partikel zat penyusunnya. Contoh: memisahkan campuran air dengan pasir.
2. Sentrifugasi
Pemisahan campuran dengan cara memutar. Contoh: pemisahan trombosit dari darah
3. Ditilasi (penyulingan)
Penyulingan atau distilasi digunakan untuk memisahkan campuran yang disusun oleh materi yang dapat menguap dan memiliki perbedaan titik didih atau titik uap. Contoh: pemisahan campuran air dengan alkohol.
4. Kromatografi
Pemisahan campuran kromatografi di dasarkan pada perbedaan kecepatan merambat atau meresap antara partikel yang bercampur pada medium tertentu. Contoh: Contohnya adalah pemisahan warna penyusun tinta hijau.
5. Sublimasi
Sublimasi didasarkan pada per daan kemampuan zat pada dalam menyublim. Contohnya pemisahan kapur barus dengan pengotornya.
6. Kristalisasi (pengkristalan)
Kristalisasi dilakukan untuk memisahkan campuran yang disusun oleh materi yang berbentuk cair dengan materi yang berbentuk padat dan memiliki sifat larut dalam air. Contohnya pemisahan garam dari air laut.
7. Ekstraksi
Pemisahan campuran dengan metode ekstraksi terjadi atas dasar perbedaan kelarutan zat terlarut di dalam pelarut yang berbeda. Contohnya: pemisahan sari kelapa dar ampasnya menggunakan air.
8. Corong pisah
Metode ini digunakan untuk memisahkan zat cair yang tidak memiliki daya larut. Contohnya pemisahan minyak dengan air.
9. Amalgamasi
Amalgamasi adalah cara pemisahan zat dengan melakukan reaksi. Misalnya, pemisahan zat untuk mendapatkan emas murni dari bijih emas.
E. Perubahan Fisika dan Perubahan Kimia
|
Perubahan Fisika |
Perubahan Kimia |
|
Tidak terbentuk zat yang jenisnya baru. |
Terbentuk zat yang jenis-nya baru. |
|
Reversibel. |
Irreversibel. |
|
Tidak terjadi reaksi kimia. |
Terjadi reaksi kimia,. |
|
Contoh: ·
Beras
dirubah mejadi tepun terigu ·
Kayu
diubah menjadi kursi ·
Gula
dilarutkan dalam air ·
Bola
lampu listrik menyala ·
Air
berubah mejadi es |
Contoh: ·
Singkong
menjadi tapai ·
Pembakaran
kayu ·
Makanan
basi ·
Sisi
diubah menjadi keju ·
Perkaratan
besi |
------------------------------------------------------------------------------------------------------------------------
MATERI VERSI PENUH
Berikut ini merupakan materi versi penuh kelas 7 : Zat dan Karakteristiknya . Selamat belajar :)
KETERANGAN: APABILA MATERI TIDAK BISA DITAMPILKAN, COBA GANTI BROWSER YANG KAMU GUNAKAN.
--------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------
VIDEO PEMBELAJARAN
Berikut ini merupakan video pembelajaran kelas 7 : Zat dan Karakteristiknya. Selamat belajar :)MOHON MAAF BELUM TERSEDIA
Berikut ini merupakan video pembelajaran kelas 7 : Zat dan Karakteristiknya. Selamat belajar :)
MOHON MAAF BELUM TERSEDIA
--------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------
DOWNLOAD MATERI DARI BUKU SISWA KURTILAS
Berikut ini merupakan materi dari buku kurtilas kelas 7 pada bab : Klasifikasi Materi dan Perubahannya. Selamat belajar :)
Berikut ini merupakan materi dari buku kurtilas kelas 7 pada bab : Klasifikasi Materi dan Perubahannya. Selamat belajar :)
--------------------------------------------------------------------------------------------------------------------------
--------------------------------------------------------------------------------------------------------------------------
















Posting Komentar untuk "[RANGKUMAN DAN MATERI LENGKAP] Zat dan Karakteristiknya"